有着“不死癌症”之称的阿尔茨海默病终于在16年后,迎来了新药上市。日前,国家药品监督管理局批准了治疗阿尔茨海默病新药——甘露特钠胶囊(GV-971,商品名“九期一”)的上市申请,“用于轻度至中度阿尔茨海默病,改善患者认知功能”。
由中国海洋大学、上海药物研究所和上海绿谷制药历时22年共同研制、开发的甘露特钠胶囊(商品名“九期一”),被指是具有完全自主知识产权的国产创新药,也是全球首个糖类多靶抗阿尔茨海默病创新药物。据上海绿谷制药对外披露的信息,“九期一”11月7日将启动生产,年内投放全国市场。
受“九期一”获批刺激,医药板块多个阿尔茨海默病概念股昨日大涨。不过,有关“九期一”III期临床结果仍在多个专业论坛被热议,而热议的后背,则有待这一新药上市后研究结果的进一步披露。
上海绿谷:年底完成铺货
南都记者采访中获悉,“九期一”获批前的III期临床,全国总计有34个临床中心参与,其中,广州市第一人民医院、中山大学附属孙逸仙医院的临床中心也参与了这一试验。
不过,在被南都记者问及III期临床是否有广东参与,临床试验中临床表现如何?与其他地方的结果相比,有何差异?截至记者截稿,绿谷制药方面并未给出进一步的回复。
依照绿谷制药董事长吕松涛日前披露的消息,“九期一”即将于11月7日投产,并于12月29日前将药物铺到全国的渠道,让中国患者受益。
那么,在完成铺货时,“九期一”的产能有多大?会如何定价?是否将参加带量采购?国际化策略是怎样的?这些问题,绿谷制药方面也未给出进一步的说法。
唯有药监局要求的上市后再评价,吕松涛“放风”,指这块的工作将于明年启动。
药监局:要求后续补充有效数据
据南都记者了解,此次“九期一”获批,除了绿谷制药的“黑历史”又被业内提及,这一阿尔茨海默病新药的III期临床结果以及随后将启动的上市后研究也备受科研界关注。
南都记者查询了解到,目前围绕“九期一”的III期临床试验(注:III期临床主要提供治疗作用和安全性,评价利益与风险关系,为药品注册申请审查提供充分依据)主要是由上海交通大学医学院附属精神卫生中心和北京协和医院牵头,全国合计34家公立医院参与的《971治疗轻、中度阿尔茨海默病的临床试验》。
根据上述临床试验公布的数据来看,南都记者了解到,该为期36周试验共纳入818名轻至中度阿尔茨海默病患者,分为安慰剂组与971组进行评价,其主要评价终点为ADAS-Cog(老年痴呆量表—认知);从该量表中,南都记者发现,971组和安慰剂组前24周发展趋势类似,但从第24周起,971组评分明显改善,即从数据上显示,“九期一”或有可能改善轻中度阿尔茨海默病的认知功能障碍。
但是针对这项临床结果,南都记者留意到其却遭遇部分业内人士的质疑,其中认证为“科学松鼠会成员”的业内人士就认为,该临床试验中,与另一个常用的指标“CIBIC评分”(临床印象变化量表)相比没有看到统计具有差异的变化;另外,该研究中亦未针对早期阿尔茨海默病患者做生物标志物检测,该标志物改善可用于证实相关疗效的证据进行使用(美国FDA针对阿尔茨海默病相关监管有此要求)。
同样的,南都记者从丁香园等医学网站等发现,部分留言的人士对于该药物上市保持“谨慎乐观”的态度。
对于相关临床试验结果是否靠谱?且有无造假的可能性?昨日南都记者就此事向广州部分三甲医院进行采访,但部分医疗机构医生以“未参与研究”等为由表示不便就此事公开表态。
“需要明确的是,现有治疗阿尔茨海默病药物,其主要作用系改善患者部分症状,真正意义上的对因治疗药物暂时还没有,因此对于此事需要谨慎乐观。”广州某三甲医院负责研究阿尔茨海默病的一名专家向南都记者坦言,从单纯的科研结果以及我国临床研究者的职业道德而言,这一临床结果涉及造假的“不太可能”,其具体效果依然要靠后续研究进行确定,“当然从情感角度来看,这个药物目前给患者及家属带来了希望”。
根据国家药监局方面针对“有条件上市”方面要求,“九期一”需继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关试验数据。换言之,若后续研究无进一步数据支持,该药物批文有可能被撤回。
同业:相关概念股普遍见涨
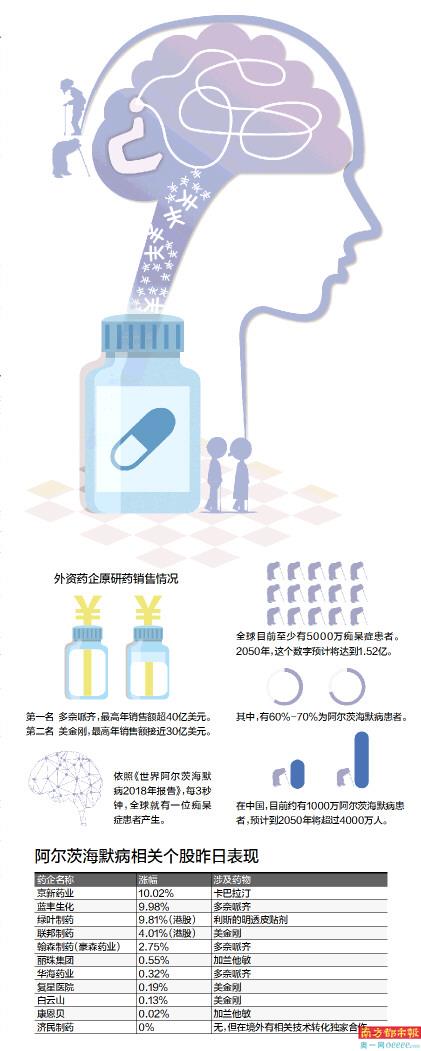
依照《世界阿尔茨海默病2018年报告》,每3秒钟,全球就有一位痴呆症患者产生。全球目前至少有5000万的痴呆患者。到2050年,这个数字预计将达到1.52亿。其中,有60%-70%为阿尔茨海默病患者。另有数据显示,在中国,目前约有1000万阿尔茨海默病患者,预计到2050年,我国的阿尔茨海默病患者将超过4000万人。
当然在“九期一”获批后的第一个交易日,相关涉及概念的医药个股股价受到提振,据南都记者不完全统计,涉及概念的11个个股中有10个收报上涨,其中拥有药物生产批件的京新制药和蓝丰生化封盘涨停,而港股绿叶制药亦有9.81%涨幅。
据南都记者了解,在“九期一”获批前,阿尔茨海默病已16年无相关新药上市,目前针对该病,主要药物为多奈哌齐、美金刚和卡巴拉汀等,从外资药企的原研药来看,销售额最高的是多奈哌齐,最高峰时超过40亿美元,第二名美金刚最高年销售额也接近30亿美元。
而日本卫材和丹麦灵北制药系这两个药物的原研方,南都记者根据卫材和灵北制药的今年三季报了解到,卫材的多奈哌齐今年前三季度在中国收入为3.82亿人民币(按昨日日元汇率计算),而灵北制药方面,虽然其并未披露美金刚的具体销售收入,但其在华增长亦达到12%,税前利润2.97亿元(按昨日丹麦克朗汇率计算)。
当然在专利期结束后,国内相关医药公司亦对上述药物加紧批文申请,其中多奈哌齐批文合计22条,美金刚合计7条,卡巴拉汀则为2条。
阿尔兹海默症药物系多家药企的研发“雷区”,据南都记者了解,多个跨国药企为了研发阿尔茨海默病新药,已投入了大量研发资金,其中不乏强生、辉瑞、罗氏、默沙东、礼来、阿斯利康等知名企业,其中礼来在2016年11月24日宣布放弃已进入III期临床的药物Solanezumab,这也被认为是“阿尔茨海研发领域最黑暗的一天”。
当然,这也并不意味着外资药企对此领域放弃,10月22日,美国渤健与日本卫材宣布,将向美国食品药品管理局(FDA)申请早期阿尔茨海默病治疗药物aducanumab的上市许可。依照渤健披露的说法,其对此前终止的两项研究更多的数据分析显示,接受高剂量aducanumab治疗的患者认知功能明显改善。
那么,在“九期一”上市后,其是否还有更多新的临床数据进行佐证?市场和定价如何?南都记者将持续关注。
采写:南都记者 贝贝 马建忠
编辑:马建忠
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。